電解液是一種可以導電的溶液����,分別由溶劑和溶質組成�����。溶劑化是指溶劑分子圍繞溶質離子形成的溶液結構,這種結構在電解液中發揮著重要的作用��。以下是用氧鍵解釋電解液中溶劑化結構的相關內容:
電解液作為電池中四大材料之一�,與正極、負極均有相互作用,電池中的有益的��、無益的反應均發生在電解質和電極的界面�,界面反應與溶劑-溶質相互作用密切相關。
近來讀了一篇中科院金屬所李峰老師的文章《為低溫鋰金屬電池設計溫度不敏感的溶劑化電解質》“Designing Temperature-Insensitive Solvated Electrolytes for Low-Temperature Lithium Metal Batteries”,里面提出”配位氧鍵“的說法,簡單來說,EC、PC��、SL這些高介電常數溶劑是氧供體溶劑�����,氧的強電負性完全阻止了Li+和陰離子的配位�����,使得電解液中Li+以溶劑分離離子對(SSIP)的形式存在,Li+與溶劑直接配位,陰離子不能直接與Li+配位。這種情況導致的結果是����,由于氧供體溶劑的強電負性,限制了(鋰金屬電池)在低溫下的可逆性和動力學性能��。其它文獻[2]也認為:電解質溶劑化殼層(solvation sheath)的脫溶劑化過程是在超低溫下工作的鋰離子電池的控制步驟��。

在低溫下工作的典型鋰離子電池配置中鋰離子擴散途徑的關鍵步驟
溶劑分離離子對(SSIP���,solvent-separated ion pair):Li+與一些溶劑強配位�����,Li+淹沒在溶劑的汪洋大海中,難以脫身�;弱溶劑化電解液的理念來源于此��。
緊密接觸離子對(CIP,contact-ion pair):一個Li+與一個陰離子配位��。Li+在溶劑的汪洋大海中終于找到一葉扁舟��。一個Li+與一個陰離子配位��,共同參與SEI的形成,SEI富含LiF��、LiPO4
小聚體(AGG��,aggregation):多個Li+與一個陰離子配位�。例如高濃度電解液��。
納米簇(cluster):由CIP�、AGG組成的一個群體��。
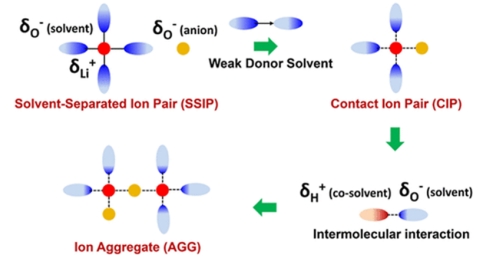
圖 1.電解質的設計原理:通過調節供體溶劑的電負性實現溶劑化設計的示意圖�。
Figure 1. Design principles and solvation regulation of the electrolyte: schematic illustration of the solvation design by electronegativity regulation of the donor solvents.
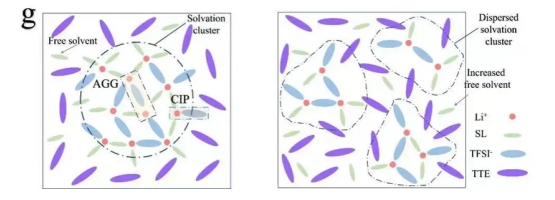
局部高濃度電解液中溶劑化團簇結構示意圖[3]
Figure 2. Schematic structure of solvation clusters in the localized high-concentration electrolyte.

圖 溶劑化結構示意圖(a)SSIP����、CIP和AGG�����;(b)納米簇
解決辦法:用一種非溶劑共溶劑來減弱醚類溶劑中供體氧的電負性�����,使陰離子供體參與到Li+的溶劑化結構中�。具體來說���,用TTE這種不溶解鋰鹽的溶劑作為共溶劑��,加入THF等醚類混合溶劑中��,來調整溶劑化結構。文章認為DMC���、DOL、DME�、THF�����、2MeTHF(2-methyltetrahydrofuran)等都是弱供體溶劑,有氧��,但是電負性較弱���,允許Li+和陰離子結合����,在低濃度電解質中形成CIP和AGG。THF和2MeTHF被選為具有較弱電負性和[敏感詞]還原穩定性的溶劑�����,用TTE這種不能與Li+配位的供體溶劑���,進一步減弱MixTHF(THF+2MeTHF)的電負性�,在LFP/Li電池中獲得優良的低溫與電化學循環性能����。文中通過觀察峰位的移動來判斷各組分之間的相互影響,值得學習。文章應用醚類電解液,雖然DME、THF等溶劑對金屬鋰具有還原穩定性���,但是卻不耐氧化,在高電壓體系中無法應用�����,所以文中只能采用LFP作為研究對象��,LFP的面容量1.5mAh/cm2��,很低。用一種低容量正極LFP與一種高容量負極Li進行匹配,NP比6�����,也許不具備產業化價值�,但是這種電解液的設計思路,尤其是從氧的角度來進行解釋,繼氫鍵�、鋰鍵后又提出了氧鍵�,這一點我個人認為是[敏感詞]的創新�。
本文原標題為用氧鍵解釋電解液中溶劑化結構,有利于行業對鍍液進一步的了解,文章轉載自網絡�����,版權歸原作者所有�。